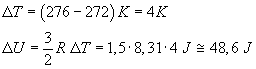
Fornendo ad una mole di gas ideale monoatomico 1210 J di calore, la sua temperatura cresce da 272 K a 276 K. Determinare il lavoro fatto dal gas in questo processo.
6,32 moli di gas ideale monoatomico si espandono da un volume di 14,1m3 a un volume di 27,6m3.
Una certa quantità di azoto, inizialmente alla pressione P0=1 Atm e alla temperatura T0=300K occupa un volume V0=5 l. Supponendo che l'azoto nelle condizioni date si comporti come un gas perfetto biatomico di massa molare Mm=28 g, calcolare:
Dalla variazione di temperatura si ottiene la variazione di energia:
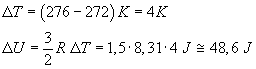
Applicando il primo principio della Termodinamica:
![]()
Trasformazione isobara
Il lavoro è dato immediatamente dal prodotto della pressione per la variazione di volume
![]()
Le temperature iniziale e finale del gas si deducono dall'equazione di stato dei gas perfetti
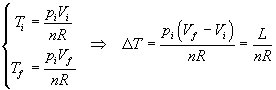
Il calore assorbito è
![]()
La variazione di energia interna è
![]()
Trasformazione isoterma
Il lavoro è
![]()
La variazione di energia interna nelle isoterme è nulla e il calore assorbito è uguale al lavoro svolto.
![]()
La massa M del gas risulta:
![]()
Per calcolare la massa molecolare si divide la massa molare per il numero di Avogadro:
![]()
In questo caso, per ottenere l'energia in Joule, conviene usare l'espressione di R in
unità S.I.
Dato che la molecole sono biatomiche, l'energia totale (cinetica di traslazione e rotazione)
risulta:
![]()
L'energia cinetica molecolare media di traslazione è data dall'equazione:
![]()
Si ottiene
![]()