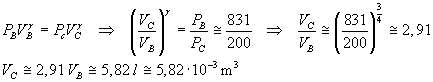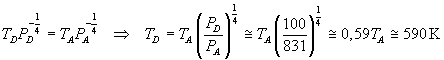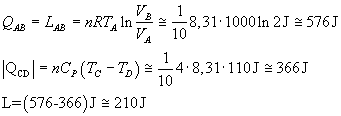Quesito 1
Un quattordicesimo di mole di gas ideale biatomico (senza vibrazioni molecolari) occupa
inizialmente un volume V0=2 litri alla pressione P0=1 Atm.
Il gas viene fatto espandere a pressione costante fino ad assumere un volume finale
V1=2V0. Calcolare:
- il calore Q01 che si è dovuto fornire al gas per ottenere questa espansione;
- la variazione dell'energia interna del gas ΔU01;
- la variazione di entropia ΔS01 del gas.
-
Si supponga che l'espansione da V0 a V1 sia un'espansione libera,
cioè senza scambi di calore e senza lavoro.
Calcolare il rapporto tra ΔS01 e la variazione di entropia
ΔS'01 dell'espansione libera.
Svolgimento
Quesito 2
Un sistema termodinamico idrostatico di massa totale M= 4,6 g, costituito molecole
poliatomiche (6 gradi di libertà), nello stato iniziale A ha volume VA=1 litro,
temperatura TA=1000 K e pressione PA=831 KPa.
Il gas si espande a temperatura costante fino allo stato B in cui assume volume
VB=2VA, si espande adiabaticamente fino allo stato C in cui la
pressione è PC=100KPa, viene compresso a pressione costante fino allo stato
D e infine viene riportato adiabaticamente allo stato iniziale A.
Considerando tutte le trasformazioni come quasi statiche calcolare:
- il numero n di moli di gas;
- il volume VC nello stato C;
- la temperatura TC del gas nello stato C;
- la temperatura TD del gas nello stato D;
- il lavoro compiuto nel ciclo;
- il rendimento del ciclo;
- la differenza tra l'entropia del gas SC nello stato C e l'entropia
SA del gas nello stato A.
Svolgimento
Svolgimento del quesito 1
-
In un'isobara le temperature sono proporzionali ai volumi, dunque
T1=2T0 e ΔT=T0. Si ottiene quindi
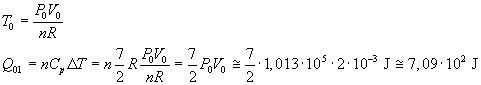
-
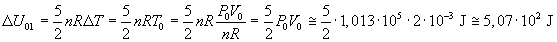
-
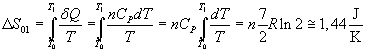
-
Dato che l'espansione libera avviene senza scambio di calore e senza lavoro, cioè
senza variazione di energia interna e quindi senza variazione di temperatura, può essere
trattata come un'espansione isoterma tra gli stessi volumi:
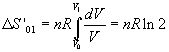
Il rapporto chiesto è quindi
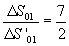
Svolgimento del quesito 2
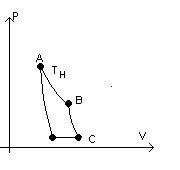
-
Dall'equazione di stato dei gas perfetti
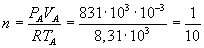
-
Nello stato B la pressione è inversamente proporzionale al volume:
PB=0,5 PA. Per il gas in esame γ=4/3; i valori di volume e pressione negli stati B e C sono
connessi dall'equazione di Poisson:
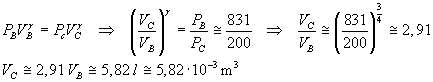
-
La temperatura in C si ottiene dall'equazione di stato:
-
La temperatura in D, collegato ad A da una trasformazione adiabatica, può essere
ricavata dall'espressione della legge di Poisson in termini di pressioni e temperature:
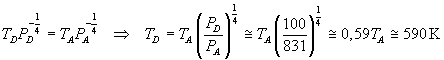
-
Il lavoro può essere calcolato dalla differenza tra i moduli del calore assorbito in AB
e quello smaltito in CD:
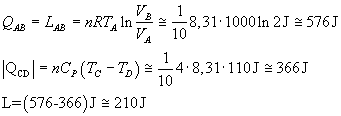
-
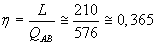
-
Nell'adiabatica BC non c'è variazione di entropia. Dunque basta calcolare la
variazione di entropia nell'isoterma AB:
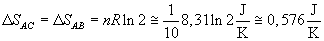
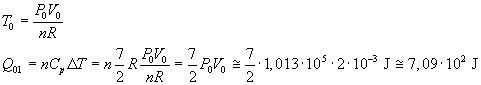
![]()
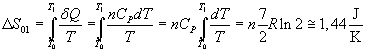
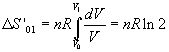
![]()