Dall'equazione di stato dei gas ideali si ottiene
![]()
La massa molare Mm è di 46 g. Dalla relazione tra energia cinetica molecolare media e temperatura si ha (N A = numero di Avogadro)
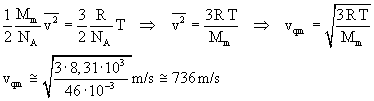
Nello stato B, per la legge di Boyle, al raddoppiamento del volume corrisponde il dimezzamento della pressione:
VB=2 10-3 m3, PB=4,155 10-5 Pa, TB = 103 K.
La relazione tra volumi e pressioni degli stati B e C è data dalla legge di Poisson con γ=4/3;
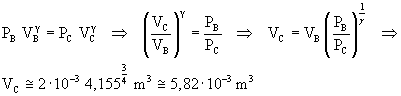
La temperatura TC si ottiene dai valori di pressione e volume nello stato C applicando l'equazione di stato dei gas ideali
![]()
La relazione tra volumi e pressioni degli stati A e D è data dalla legge di Poisson
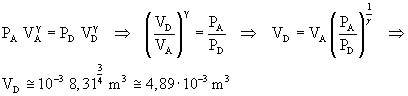
Quindi dalla legge delle isobare si ottiene TD
![]()
Considerando che nelle due trasformazioni adiabatiche non c'è scambio di calore, che il calore è assorbito (positivo) nell'isoterma e ceduto (negativo) nell'isobara, il modo più diretto di calcolare il lavoro compiuto dal ciclo consiste nel calcolare la somma algebrica tra calore assorbito e calore ceduto.
Il calore QAB assorbito nell'isoterma coincide con il lavoro eseguito:
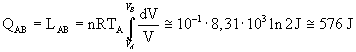
Il calore scambiato nell'isobara è
![]()
Il lavoro risulta L = 197 J.
Il rendimento si ottiene immediatamente dal rapporto tra lavoro e calore assorbito:
![]()
Dato che nell'adiabatica BC non si ha variazione di entropia, la differenza di entropia tra C e A è uguale alla differenza di entropia tra B e A:
![]()