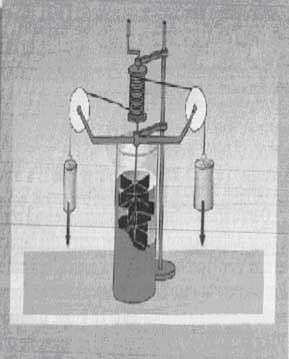
L'esperienza di Joule è stata ed è di fondamentale importanza nello studio della termodinamica perchè permette di stabilire l'equivalenza fra lavoro e calore in termini fisici e in termini di unità di misura.
E' possibile effettuare l'esperienza del mulinello di Joule utilizzando un recipiente perfettamente isolato termicamente (come un vaso di Dewar), una massa di acqua distillata a una temperatura iniziale data, un termometro che verrà inserito all'interno del calorimetro tramite un'apertura denominata collo, un asse rotante munito di agitatore nella parte immersa nell'acqua (vedi figura), una funicella avvolta a spirale sulla parte emersa dell'asse e passante nella gola di una carrucola all'altra estremità, un peso P legato alla seconda estremità della funicella.