-Differentemente dalla maggior parte delle esperienze di laboratorio non sono state le incertezze sulle singole misure a influenzare principalmente i risultati bensì le relazioni mediante cui si è arrivati al calcolo dei medesi. Considerando infatti le singole incertezze tutti i dati risultano "di ottima fattura" (in molti casi l'incertezza relativa è inferiore all' 1%), ma essendo i calcoli fondamentalmente basati su prodotti e divisioni,(considerando le formule utilizzate per calcolare la propagazione degl'errori) le misure risulteranno particolarmente penalizzate dall'elevate incertezze associate, e quindi poco attendibili.
-Espressione lampante di quanto sovraesposto è il calcolo della massa equivalente. benchè soltanto in uno dei dati iniziali (la massa d'acqua) l'incertezza relativa sia superiore all' 1%, il risultato ottenuto presenta un incertezza che si avvicina al 150% della misura(anche se in seguito è stata approssimata per difetto)! Tutt'altro che attendibile considerando che la me in quell'intervallo potrebbe anche essere negativa, sarebbe quindi il calorimetro, più freddo rispetto all'acqua, a cederle calore (tendenza che si scontra con il secondo principio della termodinamica).
-Per quanto detto si può considerare la misura del calore specifico ottentuta più che soddisfacente, essendo la sua incertezza relativa vicina al 20%.
-Come precedentemente sottolineato non è del tutto corretta, nelle condizioni di laboratorio, l'equivalenza (1cm3=1g)
Bisogna in oltre considerare gli errori "pratici" durante l'esecuzione dell'esperimento:
-Fasi critiche risultano il trafaso, in ogni passaggio da un contenitore all'altro vanno necessariamente perse piccole quantità di sostanza; e la lettura della quantità d'acqua contenuta nella provetta graduata a causa del menisco.
-Durante il trasferimento dall'acqua in cui era stato riscaldato al calorimetro il campione avrà visto diminuire la sua temperatura.
-L'errore di parallasse nella lettura dei volumi sulle scale graduate delle provette.
-è possibile inoltre che non tutta la massa del campione ma solamente la parte più esterna abbia acquistato la temperatura dell'acqua in cui era immerso, influenzando conseguentemente anche la quantità di calore ceduto in seguito.
-Per la sua misurazione l'acqua, dopo essere stata riscaldata, viene trasferita in un cilindro graduato, il quale trovandosi a temperatura ambiente e avendo a disposizione un lasso di tempo sufficiente, ha la possibilità di privare l'acqua di una certa quantità di calore.
-Considerando i dati di partenza e le procedure utilizzate, risultano poche le migliorie applicabili all'esperimento. Nel calcolo della massa equivalente utilizzare 150 cm3 d'acqua per abbassare l'incertezza relativa (nota:la capacità del calorimetro è 300 cm3); utilizzare strumenti più precisi e sensibili per la misura di temperatura e tempo; diminuire gli intervalli di rilevazione dei tempi;misurare in modo "diretto" le masse d'acqua attraverso un bilancia elettronica potendono quindi abbassare l'incertezza associata; utilizzare procedure più "veloci"(es.nel trasferimento dell'oggetto riscaldato)e accurate(nel travasare le masse d'acqua).
La temperatura di equilibrio
-Per il secondo principio della termodinamica quando due sistemi vengono messi a contatto vi è trasferimento di energia in forma non meccanica (calore) fino a che non si viene a creare uno stato di equilibrio termico (stessa temperatura). Una volta raggiunto questo stato, se il sistema che si sta analizzando è isolato , la temperatura rimane costante.
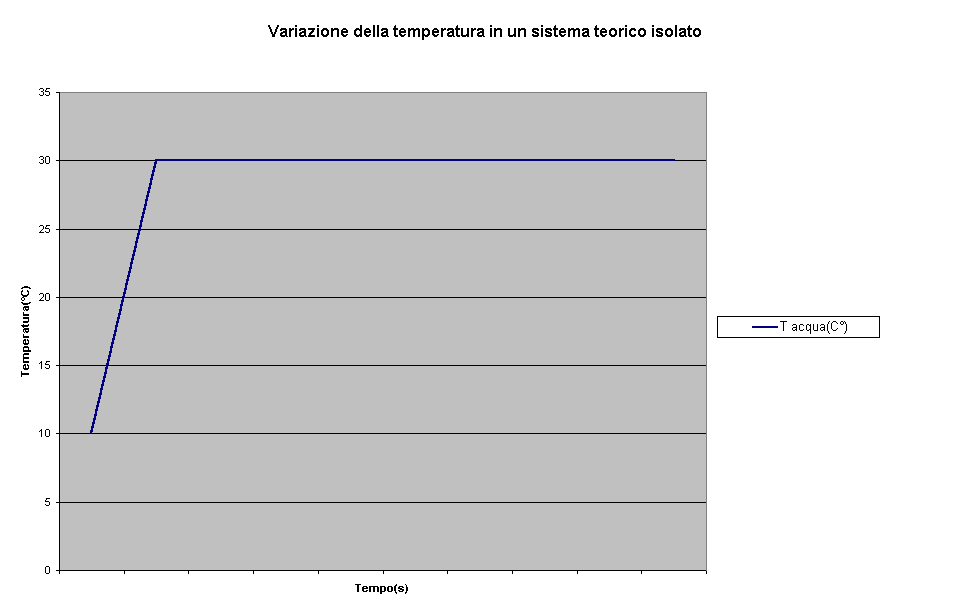
Un rappresentazione grafica di questa "trasformazione" ideale:

-Confrontandola con la rappresentazione grafica dei risultati ottenuti in laboratorio sia per il calcolo della massa equivalente del calorimetro, sia per il calcolo del calore specifico si può osservare la "bontà" degli strumenti utilizzati:
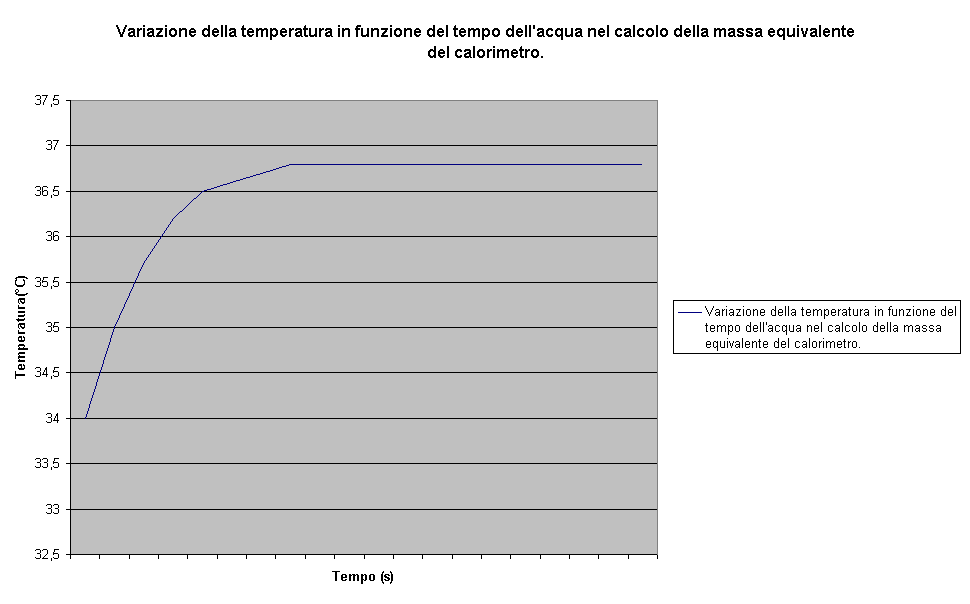
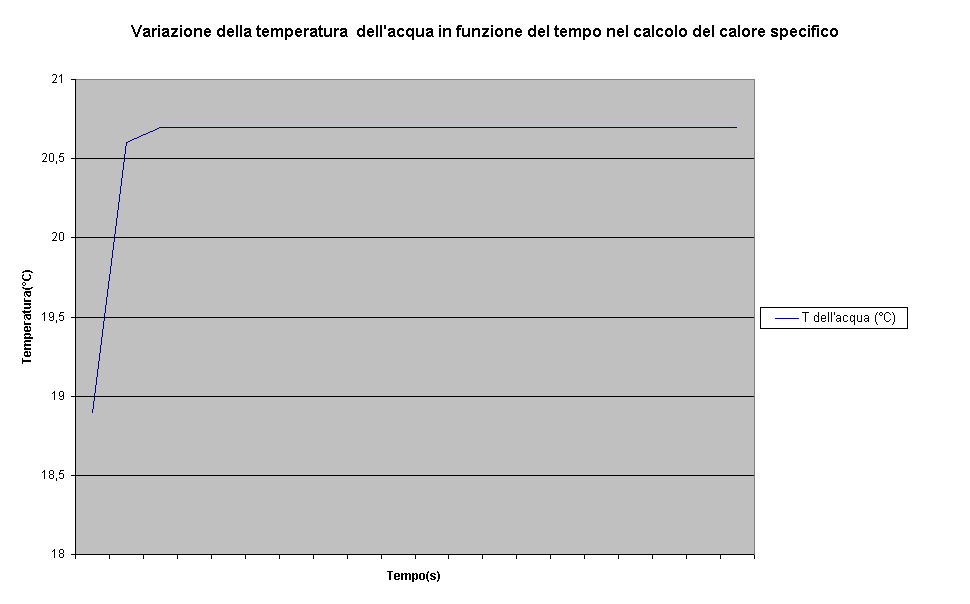
-In particolare è molto interessante l'isolamento termico che il calorimetro è riuscito a mantenere per diversi minuti(non è stato possibile rilevare un abbassamento successivo della temperatura) sottolineando l'accuratezza e l'ottimo funzionamento delle precauzioni prese per evitare dispersioni di calore.
-La fase di "salita" del grafico non coincide, ovviamente, con quella ideale in quanto è materialmente impossibile rilevare istante per istante infinitesime variazioni di temperatura
-La temperatura di equilibrio si potrà quindi considerare con ottima approssimazione quella raggiunta e mantenuta dal sistema in entrambe le situazioni. L'incertezza associata risulta essere una forma di "compromesso": si è cercato di mantenerla bassa per sottolineare l'affidabilità dello strumento, ma non potrà risultare nè inferiore nè ragionevolmente uguale all'incertezza associata alle misure "dirette" delle temperature; es. (97.0±0.1)°C.
La presentazione dei risultati..
-..sul calore calore specifico è stata fatta in cal(piccole calorie). essendo:
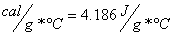
-per presentare il risultato con le unità S.I. si dovrà moltiplicare per 4186 ottenendolo in:
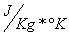
-avendo sempre utilizzato delle variazioni di temperatura il passaggio dalla scala Celsius a quelle Kelvin non provoca variazioni. Il calore specifico risulerà essere:
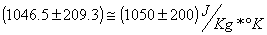
-Considerando l'incertezza associata l'elemento costituente l'oggetto risulterà probabilmente essere alluminio (cs=0.215 cal/g*°C). (escludendo a priori che possa trattarsi di una lega..).