


|  |
|
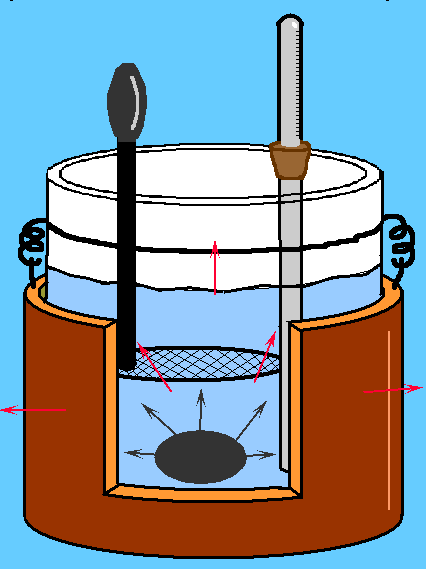
Il calorimetro di Regnault (o delle mescolanze) è un'apparato sperimentale che permette di misurare le proprietà termiche delle sostanze (calore specifico, poteri calorifici,..), nonchè le quantità di calore cedute o assorbite durante un processo fisico o chimico.
|
|
|
Le osservazioni sperimentali sugli scambi termici portano alla considerazione che la quantita' di calore ceduta da un corpo aumenta con l'aumentare della sua temperatura. Se due corpi composti della stessa sostanza, ma di differente massa, mantengono la stessa temperatura, cedono due diverse quantita' di calore (in particolare ne cede di piu' quello di massa maggiore), e quindi a parita' di condizioni,la quantita' di calore ceduta da un corpo dipende dalla natura del corpo stesso. Il calore specifico è una proprietà delle sostanze, ed è ricavabile attraverso la seguente formula:
dove Q e' la quantita' di calore ceduta dal corpo di massa m quando la temperatura diminuisce di Δ t gradi, e la costante che giustifica la diretta proporzionalità fra massa, variazione di temperatura e la quantità di calore, è proprio il CALORE SPECIFICO del corpo.
Considerando all'interno dello strumento una quantità d'acqua (ma) si potrà denominare la sua temperatura tf, pari a quella ambiente(20°C circa). Si utilizzerà inoltre un oggetto campione la cui massa sarà mc e la cui temperatura sarà tc. Dopo aver scaldato il campione in acqua bollente, se questo verrà introdotto all'interno del calorimetro cederà calore all'acqua, in base al secondo principio della termodinamica; lo scambio di energia terminerà quando le temperature del campione e dell'acqua coincideranno.
ove te indica la temperatura d'equilibrio al termine dello scambio di calore tra il campione e l'acqua. Si sa inoltre che il calore specifico dell'acqua equivale a 1; quindi la formula si ridurrà a Il calore ceduto dal campione sarà invece
Riprendendo il secondo principio della termodinamica, i calori così ottenuti corrispondono allo stesso valore quindi è possibile uguagliarne le formule. Isolando il calore specifico del campione otterremo: |
|
L'EQUIVALENTE IN ACQUA DEL CALORIMETRO