L'ultima e più rigorosa conferma ottocentesca dell'ipotesi di Avogadro arrivò finalmente con la teoria cinetica dei gas e con l'elettromagnetismo in particolare con Boltzmann e Maxwell: la costante universale dei gas R e quella di Faraday sono direttamente proporzionali al numero di Avogadro, e in particolare risultano essere espressioni macroscopiche rispettivamente dalla costante di Boltzmann e della carica dell'elettrone, grandezze microscopiche fondamentali.
Col nome di numero di Avogadro venne quindi proposto da Perrin di chiamare il numero di molecole contenute in una grammomolecola (oggi mole) di qualsiasi sostanza, a sua volta definita come quantità di sostanza contenente inizialmente lo stesso numero di particelle (il numero di Avogadro) di quelle contenute in 2 grammi di idrogeno molecolare, e dal 1971 lo stesso numero di particelle contenute in 0,012 kg (12 grammi) di 12C.
In effetti Avogadro non si pose mai direttamente il problema di fissare assolutamente il numero di particelle contenute in un volume di gas (a temperatura e pressione fissate), essendo interessato da chimico a stabilire le quantità di sostanze che potevano reagire completamente (senza residui) e a prevedere la quantità dei prodotti: gli si dedicò la costante con lo scopo di riconoscere la sua derivazione diretta dalla legge da lui formulata.
PROCEDIMENTO:
Punto chiave dell'esperimento è la realizzazione di uno strato monomolecolare ( o monoatomico) di sostanza a volume noto (con conseguente basso coefficiente di comprimibilità), il calcolo del suo spessore e l'utilizzo dell'ultimo per ottenere il volume molecolare della sostanza.
Senza fare ricorso a complessi metodi elettrochimici in grado di depositare uno strato pressoché monoatomico di metallo, peraltro difficile da maneggiare, sfrutteremo la spinta di Archimede agente su una piccola porzione di un fluido a bassa volatilità che lo rende galleggiante su di un'altro più denso, ma soprattutto le intense forze intermolecolari. Se la prima garantisce la monomolecolarità dello spessore, facendo emergere le molecole sugli strati più profondi fino alla superficie di contatto con l'aria (fluido meno denso di quello considerato), la seconda impedisce la frammentazione interna dello strato che rende più veloce e preciso il calcolo dell'area.
| L'acido (cis-)oleico risponde alle nostre esigenze: ha bassa tensione superficiale (si espande velocemente), alta temperatura di fusione e di ebollizione, tensione di vapore, e quindi in generale bassa energia cinetica molecolare, ha bassa densità e ancor più bassa solubilità in acqua in quanto apolare, è costituito da molecole molto grandi e inoltre è di molto facile reperibilità, essendo il componente principale dell'olio d'oliva (questo fu il liquido utilizzato inizialmente nell'esperimento, ma essendo un miscuglio, varia le sue proprietà in base alla concentrazione dei componenti) . |
| Per aumentare la probabilità che lo strato formatosi sia monomolecolare è opportuno mescolare lentamente l'acido oleico giallo in esano (non pentano in quanto ha troppo alta velocità di evaporazione e falserebbe la concentrazione), liquido apolare, in soluzione a concentrazione volumica 1:10000; nell'esperienza realizzata in laboratorio si è inizialmente titolata una prima soluzione, in un cilindro graduato con 1ml di sensibilità, costituita da 1ml di acido oleico in 1 dl di esano, poi si è titolata la soluzione finale nello stesso sito diluendo ulteriormente 1ml della prima soluzione in 1 dl di esano. |
Si è trasferito quindi, mediante una pipetta di sensibilità 0.1cc, 1ml della seconda soluzione sulla superficie precedentemente cosparsa di polvere idrofoba di licopodio per evidenziare l'altrimenti invisibile macchia (servirsi di una saliera per evitare che precipiti o si bagni) di una vaschetta (sotto cui era stata posta della carta millimetrata) riempita d'acqua del rubinetto (e non distillata). La deposizione della soluzione nella vaschetta dovrebbe essere eseguita moooolto lentamente così da non fare inglobare né bagnare alla macchia del licopodio e in modo da non farle toccare i bordi della vaschetta: in entrambi i casi l'area risulta falsata poiché viene limitata l'espansione dell'acido oleico. Sempre nell'utopia sarebbe preferibile ottenere un'area tonda, che ha basso errore di misurazione. Dopo un'attesa di qualche minuto in cui approssimativamente tutto l'esano avrebbe dovuto essere evaporato, si è scattata una fotografia su cui è stata misurata l'area della macchia, e in cui risalta evidentemente che le condizioni di cui sopra sono state di gran lunga lontane da quelle realizzate in laboratorio; siamo però riusciti almeno a impedire il contatto macchia-bordo (abbiamo utilizzato un programma di elaborazione grafica per annerire il licopodio asciutto).
MISURAZIONE INDIRETTA:
Tenendo presente che il volume macchia dovrebbe ora essere 1/10000 di ml (è rimasto il solo acido oleico), e ricavandone la superficie graficamente, possiamo iniziare a valutare lo spessore dello strato, cioè della molecola di acido oleico.
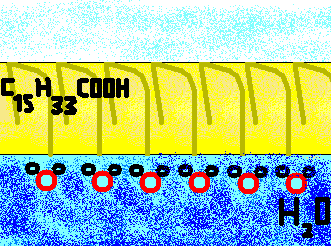 |
L'acido oleico è costituito da molecole anfipatiche: la presenza del gruppo carbossilico (COOH) sempre idrofilo che giace all'estremità del braccio C1C9 ci permette di capire che la molecola si dispone con quest'estremità verso l'acqua, con cui crea legami ad idrogeno. L'estremità idrofoba è invece costituita dal braccio C10C13 in cui dominano i radicali CH3 che si dispone verso la superficie di contatto con l'aria: schematicamente ciò è illustrato dalla figura a sinistra. | |
| Ma considerando che il braccio C1C9 essenzialmente altro non è che una catena di legami carbonio-carbonio dove questo è ibridato (l'ibridazione di un atomo è deducibile dal numero di atomi che gli sono legati: sp-->2, sp2-->3, sp3-->4) sp3 (tranne il C8 e il C9 che sono ibridati sp2), abbiamo considerato ogni carbonio dall'1 all'8 centro di un tetraedrocome in figura. A questo punto possiamo ipotizzare approssimativamente che il braccio maggiore C1C9 della molecola sia il suo spessore senza la distanza che la separa dalle molecole d'acqua sottostanti, ovvero la distanza dei legami ad idrogeno. | ||
La lunghezza dell'intero braccio risulterà allora essere 4 volte la distanza tra C1 e C3, che sta alla distanza tra C1 e C2 come il lato di un tetraedro sta al raggio della sfera circoscritta. (le due figure a sfondo bianco non rappresentano la reale forma della molecola: sono state costruite per illustrare i diversi bracci)
| Non conoscendo però esattamente numero e disposizione spaziale di questi legami ad idrogeno, non ci resta che accontentarci di verificare la corrispondenza degli ordini di grandezza. Quando questa fosse verificata, si procederebbe al calcolo con lo stesso metodo (associandovi onestamente un errore relativo molto alto) della lunghezza del braccio C10C13, che secondo ragionamenti analoghi ai precedenti, dovrebbe situarsi intorno ai tre legami singoli carbonio-carbonio. Conoscendo la reale forma della molecola (nel paragrafo sopra "procedimento"), dato che il braccio C14C18 è leggermente inclinato rispetto al piano che contiene gli altri due, abbiamo approssimato la molecola ad un cilindro a base ellittica dove il braccio C1C3 rappresenta la diagonale dell'ellisse, di lunghezza compresa tra quella dell'asse minore e quella dell'asse maggiore, per poterne apprezzare il volume. |
| Passando per il volume della singola molecola abbiamo potuto allora procedere al calcolo della sua massa, essendoci nota la densità dell'acido oleico, e da qui infine al Numero di Avogadro, rapporto tra la massa molare dell'acido oleico e la massa della sua molecola. |